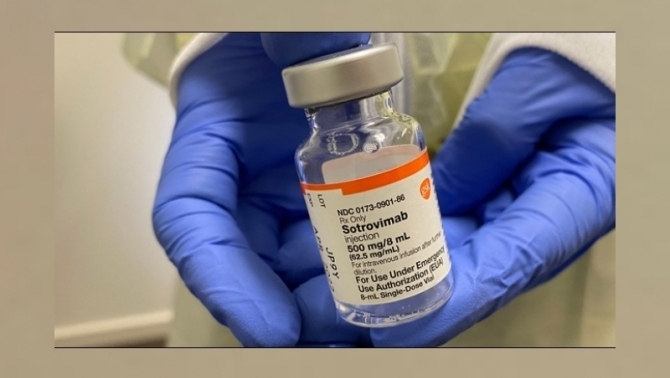
องค์การอาหารและยา(FDA) ในฐานะหน่วยงานกำกับกฎระเบียบสาธารณสุขของสหรัฐฯ เปิดเผยว่า สหรัฐฯไม่อนุญาตให้ใช้ยาแอนติบอดี โซโตรวิแมบ (Sotrovimab) ซึ่งมีชื่อทางการค้าว่า เซวูดี” (Xevudy) ของบริษัทแกล็กโซสมิทไคลน์ (GSK) ของอังกฤษและบริษัทเวอร์ ไบโอเทคโนโลยี (Vir) ของสหรัฐฯ ในการรักษาโรคโควิด-19 ในสหรัฐฯอีกต่อไป หลังมีข้อมูลชี้ว่า ยาโซโตรวิแมบ ไม่มีประสิทธิภาพในการป้องกันไวรัส BA.2 สายพันธุ์ย่อยของไวรัสโอไมครอน ซึ่งระบาดเร็วกว่าสายพันธุ์ก่อนๆ อีกทั้งในปัจจุบัน เป็นสายพันธุ์หลักที่ระบาดอยู่ในสหรัฐฯ คิดเป็นสัดส่วน 3 ใน 4 ของผู้ป่วยใหม่ทั้งหมดในสหรัฐฯ
คำสั่งนี้มีผลเท่ากับเพิกถอนคำสั่งเดิมเมื่อเดือนที่แล้ว ซึ่ง FDA อนุญาตให้ใช้ยาโซโตรวิแมบ สำหรับการรักษาคนไข้โควิด-19 ในพื้นที่ส่วนใหญ่ทางภาคตะวันออกเฉียงเหนือของสหรัฐฯ
ด้านบริษัท GSK และบริษัท Vir ยืนยัน ผลวิจัยของบริษัททั้งสองว่า ยาโซโตรวิแมบ สามารถกระตุ้นแอนติบอดีหรือภูมิคุ้มกันในร่างกายสูงพอที่จะป้องกันไวรัส BA.2 แต่ผู้เชี่ยวชาญหลายคน รวมทั้งนักวิจัยจากมหาวิทยาลัยโคลัมเบียไม่เห็นด้วย
บริษัท Vir ซึ่งเป็นบริษัทจดทะเบียนในตลาดหุ้นนิวยอร์ก ส่งหนังสือชี้แจงต่อคณะกรรมการกำกับตลาดหลักทรัพย์ของสหรัฐฯว่า ทั้งบริษัท GSK และบริษัท Vir อยู่ระหว่างเตรียมจัดทำข้อมูลเพิ่มเติมเพื่อสนับสนุนผลวิจัยของบริษัทว่า การเพิ่มปริมาณยาโซโตรวิแมบให้มากขึ้นจะมีประสิทธิภาพสูงขึ้นในการรักษาคนไข้ที่ป่วยจากไวรัส BA.2 พร้อมทั้งจะนำเสนอผลวิจัยนั้นให้กับหน่วยงานกำกับกฎระเบียบสาธารณสุขทั่วโลก ทั้งย้ำผลวิจัยของบริษัทในเดือนที่แล้ว ยาดังกล่าวลดความเสี่ยงการรักษาในโรงพยาบาลและการเสียชีวิตลงได้ร้อยละ 79
ด้านหน่วยงานกำกับดูแลผลิตภัณฑ์ยาและผลิตภัณฑ์สุขภาพ (MHRA)ของสหราชอาณาจักรได้อนุมัติให้มีการใช้ยาโซโตรวิแมบ เพื่อใช้สำหรับผู้ป่วยโควิด-19 ที่มีอาการเล็กน้อยถึงปานกลาง และผู้ที่มีความเสี่ยงสูงที่จะเกิดอาการป่วยรุนแรงโดยมีเป้าหมายเพื่อยับยั้งการเกิดอาการป่วยรุนแรงของผู้ที่ได้รับเชื้อโควิด-19 และมีประโยชน์สำหรับผู้ที่มีภูมิคุ้มกันไม่แข็งแรง ซึ่ง MHRA แนะนำให้ใช้ยาดังกล่าวโดยเร็วที่สุดหรือภายใน 5 วันหลังเริ่มมีอาการป่วย
#สหรัฐฯ
#ยกเลิกใช้ยาโซโตรวิแมบ
#โควิด19
 ข่าวทั้งหมด
ข่าวทั้งหมด